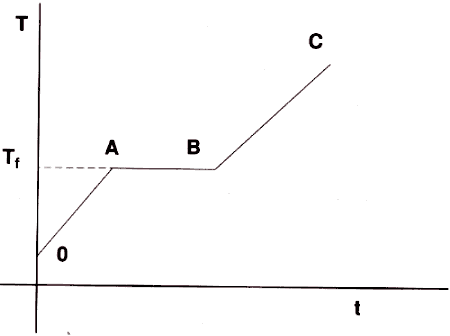
Si por medio de un mechero calentamos un recipiente en el que se hayan depositado unos trozos de plomo, y registramos la temperatura a intervalos regulares de tiempo -por ejemplo cada 15 s-observaremos que va aumentando de forma continua y uniforme, tal como se detalla en el tramo 0A de la fig. 1. Este proceso obedece al hecho de que todo el calor suministrado por el mechero se está empleando en elevar la temperatura del plomo (calor sensible).
Cuando la temperatura alcanza un cierto valor T, (temperatura de fusión), aparecen en el recipiente las primeras gotas de plomo líquido, con lo que comienza el proceso de fusión; mientras dura éste, la temperatura permanece estacionaria (tramo AB), debido a que todo el calor suministrado por el mechero se está empleando en romper las fuerzas de cohesión que mantenían al plomo en estado sólido (calor latente).
En el momento que todo el plomo ha pasado al estado líquido, la temperatura comienza de nuevo a ascender (tramo BC), ya que de nuevo el calor suministrado por el mechero se emplea en elevar la temperatura (calor sensible).

Tenemos ahora un cuerpo sólido, como por ejemplo una barra de hielo; ya hemos dicho que sus moléculas se moverán más o menos rápidamente según sea la temperatura del cuerpo
Añadamos más y más calor al cuerpo, las moléculas al ir aumentando su energía, se irán acelerando más y más conforme aumente su temperatura hasta llegar a un punto en que al no poderse acelerar más, romperán su estructura intermolecular (ligaduras) pasando a otra más amplia, de más energía.
Si entonces continuamos añadiendo calor, este se invertirá en ir cambiando de estado. El sólido pasará a líquido. Todo el calor añadido para el cambio de estado a partir de su ruptura estructural, lo llamamos latente, porque no produce variación en la temperatura.
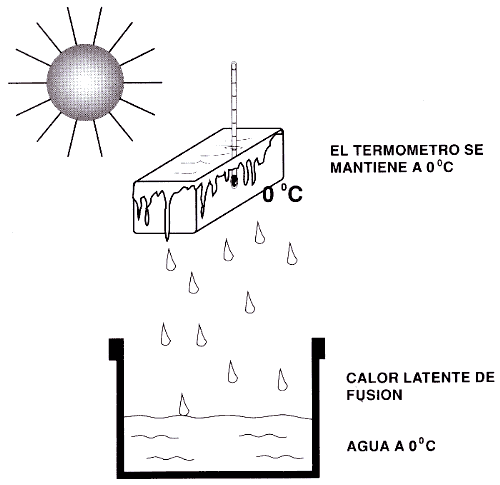
Temperatura de fusión .- Es aquella a la que comienza la fusión y que permanece estacionaria durante el desarrollo de la misma.
Calor de fusión.- Calor de fusión de una sustancia es el que necesita para fundir una unidad de masa de la misma, una vez alcanzada la temperatura de fusión.
En la tabla que aparece a continuación se detallan las temperaturas y calores de fusión de algunas sustancias de uso frecuente:
| TEMPERATURA Y CALOR DE FUSIÓN DE ALGUNAS SUSTANCIAS | ||
|---|---|---|
| Sustancia | Temperatura de fusión (°C) | Calor de fusión (cal/g) |
| Agua Aluminio Cobre Hierro Plomo | 0 657 1.083 1.540 327 | 80 77 42 48 5,5 |
Calcular la cantidad de calor que se necesita para fundir 500 g de plomo que se encuentra a 15 °C (calor específico c = 0,03).
En principio, se calcula el calor necesario para calentar el plomo desde 15 °C hasta su temperatura de fusión, 327 °C:
Q1 = m · c · At = 500 · 0,03 ·(327 - 15) = 500 · 0,03 · 312 = 4.680 cal
A continuación, calculamos el calor necesario para fundir el plomo:
Q2 = masa · calor de fusión = 500 · 5,5 = 2.750 cal
En consecuencia, el calor total necesario, será:
Q = Q1 + 2 = 4.680 + 2.750 cal ; Q = 7.430 cal
Fuente de información:
CURSO DE AIRE ACONDICIONADO
